Artigos relacionados
Estratégias de ensino-aprendizagem
Aula sobre solubilidade e polímeros: Remodelando o isopor
Confira uma proposta de aula sobre solubilidade e polímeros que traz um experimento de remodelação do isopor!
Estratégias de ensino-aprendizagem
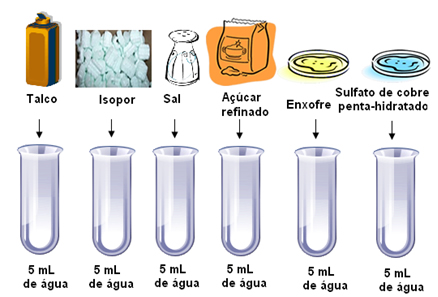
Compondo soluções saturadas
É possível acrescentar mais soluto a essas soluções?
Estratégias de ensino-aprendizagem
Forças intermoleculares e solubilidade
Experimento que permite testar qual substância é polar e apolar.
Estratégias de ensino-aprendizagem
Solubilidade relacionada ao solvente
O que faz uma substância ser solúvel?