PUBLICIDADE
“Serpente de Faraó” é o nome dado a uma experiência clássica de Química em que se queima o tiocianato de mercúrio (Hg(SCN)2). A partir de uma pequena amostra, começam a crescer estruturas semelhantes a uma cobra de cinzas. No entanto, essa é uma experiência que não pode ser realizada em sala de aula, pois libera vapores bastante perigosos.
Mas existe uma alternativa de experimento que tem um efeito visual um pouco menor que esse, mas que também é interessante e pode ser utilizado em sala de aula ao se estudar o conteúdo de “Combustão”. Veja como é fácil:
Materiais e reagentes:
- Almofariz e pistilo (ou um pilão com socador, igual ao que os cozinheiros usam para amassar alho);
- Uma seringa;
- Bicarbonato de sódio;
- Açúcar;
- Álcool;
- Algum recipiente com graduação para medir o volume do álcool;
- Colher;
- Fósforos;
- Recipiente com areia;
- Pinça metálica.

Procedimento Experimental:
1. Coloque no almofariz uma parte de bicarbonato para duas de açúcar, triture bem com o pistilo, formando um pó bem fininho e misture-os;

2- Adicione algumas gotinhas de álcool para que a mistura dê liga;
3- Corte a parte da seringa onde se coloca a agulha e coloque dentro dela essa mistura, a fim de formar uma espécie de coluna. Quanto maior você fizer, maior será o resultado do experimento. Depois, empurre com o êmbolo para que a coluna saia da seringa e deposite-se sobre a areia;
4- Derrame cerca de 20 mL de álcool ao redor dessa coluna;
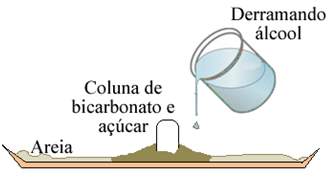
5- Com muito cuidado, coloque fogo no sistema. Você observará que à medida que queima, a coluna vai ficando preta e vai crescendo. Com a ajuda da pinça e com muito cuidado para não se queimar, vá guiando a “serpente” para que ela cresca no sentido que desejar.
Resultado e Discussão:
O açúcar comum é a sacarose (C12H22O11) e o bicarbonato de sódio é o sal hidrogenocarbonato de sódio ou carbonato ácido de sódio (NaHCO3).
Quando a sacarose queima, ocorre a sua combustão completa e, assim como ocorre com todos os compostos formados por carbono, hidrogênio e oxigênio, os produtos liberados são dióxido de carbono e água:
C12H22O11(s) + 12 O2 (g) → 12 CO2(g) + 11 H2O(l)
Ocorre também a decomposição térmica do bicarbonato:
2 NaHCO3(s) → Na2CO3(s) + CO2(g) + H2O(l)
Na2CO3(s) → Na2O(s) + CO2(g)
Além disso, nesse processo também ocorre a combustão incompleta da sacarose, em que um dos produtos é o carbono, constituinte do carvão. É por isso que se forma a estrutura de cor preta. O gás carbônico liberado tanto na combustão completa da sacarose quanto na decomposição do bicarbonato faz a estrutura de carbono inflar, crescendo, e é isso que dá o efeito de uma serpente subindo.
* Crédito editorial: Autor: Tomasz Szymborski/Extraído de: Wikipedia Commons
Por Jennifer Fogaça
Graduada em Química







