Professor, esta proposta de aula experimental tem como objetivo ajudar os alunos a verem como os efeitos da chuva ácida sobre a natureza podem ser devastadores. Ela é mais indicada para uma aula de Química, pois a explicação do resultado desse experimento depende das reações químicas que formam a chuva ácida.
Realize essa demonstração dos efeitos da chuva ácida em um laboratório de ciências que possua uma capela para aspirar os gases que serão gerados ou em um local bem ventilado.
Materiais e Reagentes:
* Pote de vidro com tampa (pode ser embalagens de azeitona, palmito, etc.);
* Fita isolante;
* Uma rosa vermelha;
* Pó de enxofre (pode ser encontrado em farmácias ou lojas de produtos naturais);
* Uma colher (de café) fácil de ser entortada;
* Uma vela ou um bico de Bunsen;
* Água;
* Papel indicador de pH (opcional).
Procedimento Experimental:
1- Adicione uns três dedos de água no pote de vidro;
2- Com a fita isolante, prenda o cabo da flor em um dos lados do pote de vidro sem encostar na água;
3- Do outro lado, você pode prender um papel indicador de pH;
4- Entorte a colher para que ela possa ser presa na tampa do pote de vidro, deste jeito:
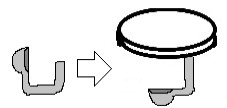
Parte de experimento sobre chuva ácida – colher entortada pregada em tampa de pote de vidro
5- Coloque um pouco de pó de enxofre na colher e queime em baixo dela com a chama da vela ou Bico de Bunsen;
6- Quando começar a sair uma fumaça, pare de queimar o pó de enxofre e tampe rapidamente o pote de vidro. O experimento ficará da seguinte forma:

Esquema de aparelhagem de experimento sobre os efeitos da chuva ácida
7 - Observe o que acontece com a flor com o passar do tempo. Lembre-se de abrir o pote em um lugar bem ventilado para não respirar os gases formados.
Resultados e discussões:
Toda chuva é naturalmente ácida (pH < 7), pois a água reage com o gás carbônico (CO2) presente na atmosfera e forma o ácido carbônico (H2CO3). Assim, a chuva tem um pH de cerca de 5,6.
O problema ambiental que é chamado de “chuva ácida” ocorre quando existem os óxidos de nitrogênio na atmosfera, que reagem com a água da chuva, formando o ácido nítrico (HNO3) e o ácido nitroso (HNO2), que, ao longo do tempo, podem causar certo impacto ambiental.
Não pare agora... Tem mais depois da publicidade ;)
N2(g) + 2 O2(g) → 2 NO2(g)
NO2(g) + H2O(l)→ HNO2(aq) + HNO3(aq)
Esse problema agrava-se ainda mais com a presença dos óxidos de enxofre, pois, conforme as equações químicas a seguir mostram, eles reagem com a água e formam o ácido sulfúrico, o mesmo ácido usado em baterias de automóveis, que é um ácido muito forte:
S(s) + O2(g) → SO2(g)
SO2(g) + H2O(l)→ HSO3(aq) (Ácido sulfuroso)
SO2(g)+ ½ O2(g) → SO3(g)
SO3(g) + H2O(l)→ H2SO4(aq) (Ácido sulfúrico)
Esses gases são provenientes principalmente da queima de combustíveis fósseis em indústrias e em veículos automotivos.
Por essa razão, o pH da água da chuva fica muito baixo, cerca de 4,5, o que causa inúmeros estragos ambientais, como destruição de folhas e galhos das árvores, contaminação do solo, provocando a sua alteração química; contaminação de rios e lagos, levando à morte de peixes; bem como de águas subterrâneas; surgimento de doenças respiratórias; além de degradação de estátuas, monumentos históricos, materiais usados na construção civil e estruturas metálicas de prédios e pontes.
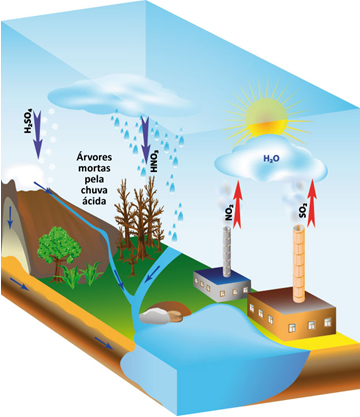
Fatores que levam à formação da chuva ácida
O experimento realizado aqui foi uma demonstração em pequena escala dos efeitos da chuva ácida. Quando queimamos o pó de enxofre, ele reage com o oxigênio presente no ar e forma o dióxido de enxofre (S(s) + O2(g) → SO2(g)).
Em contato com a água dentro do pote de vidro, o dióxido de enxofre forma o ácido sulfuroso (SO2(g) + H2O(l)→ HSO3(aq) ). Ele pode também reagir com o oxigênio presente no ar dentro do pote e formar o trióxido de enxofre (SO2(g)+ ½ O2(g) → SO3(g)), que, por sua vez, reage com a água dentro do pote e forma o ácido sulfúrico (SO3(g) + H2O(l)→ H2SO4(aq) ).
É por isso que a flor perde a cor. Olhando a cor do papel indicador de pH e comparando-o com o padrão vindo na sua caixinha, é possível mostrar para os alunos o valor aproximado do pH da "chuva ácida caseira" formada dentro do pote de vidro.
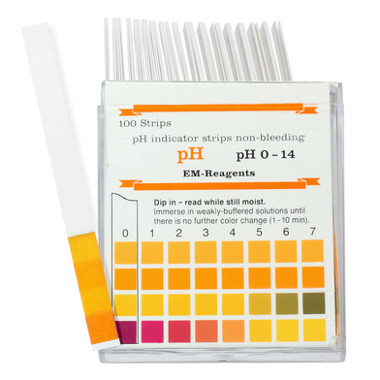
Papel indicador de pH mostrando pH próximo a 4
Por Jennifer Fogaça
Graduada em Química











